

铁死亡在肝纤维化治疗中的作用机制
2012年,哥伦比亚大学Brent R. Stockwell团队首次提出了一种名为铁死亡的新型细胞程序性死亡方式。从此,铁死亡相关研究热潮逐年攀升。这期小编将带领大家探究铁死亡调控与肝纤维化的作用机制。

与细胞凋亡和细胞自噬不同,铁死亡是一种依赖铁的过程。铁死亡的本质是谷胱甘肽(GSH)的耗竭和谷胱甘肽过氧化物酶4(GPX4)活性的降低。当谷胱甘肽过氧化物无法被GPX4催化还原,脂质过氧化物将无法代谢,从而破坏细胞膜的完整性,导致细胞死亡。铁死亡在形态学、生物化学和遗传学上有其独特的表征。
● 形态特征
● 生化特征
铁聚积,脂质过氧化,丝裂原活化蛋白酶(MAPKs)系统激活,胱氨酸-谷氨酸反向转运体(System Xc-,由SLC7A11的SLC3A2组成的异二聚体)抑制胱氨酸摄取降低,谷胱甘肽(GSH)耗竭,NAPDH氧化增加,释放花生四烯酸介质(如11-HETE和15-HETE)等。
●免疫特征
释放损伤相关的分子模式(DAMPs),促进炎症反应。
铁代谢与铁死亡
铁死亡与肝纤维化
纤维化疾病由细胞经历持续慢性损伤的复杂病理过程发展而来,铁死亡相关机制在纤维化疾病进展中发挥重要的调控作用。肝纤维化的主要病理特征是肝脏内HSC的活化与ECM过度沉积,汇管区大量纤维结缔组织异常增生,进而破坏肝脏正常结构以及生理功能。因此,抑制HSC的活化及增殖,诱导HSC死亡是治疗肝纤维化的有效方法。研究表明,HSC中储存有大量的铁离子,铁死亡可以通过调控HSC内铁离子含量以及脂质过氧化程度等影响肝纤维化的发展进程,因此靶向HSC铁死亡可能成为治疗肝纤维化的新策略[1](图1)。
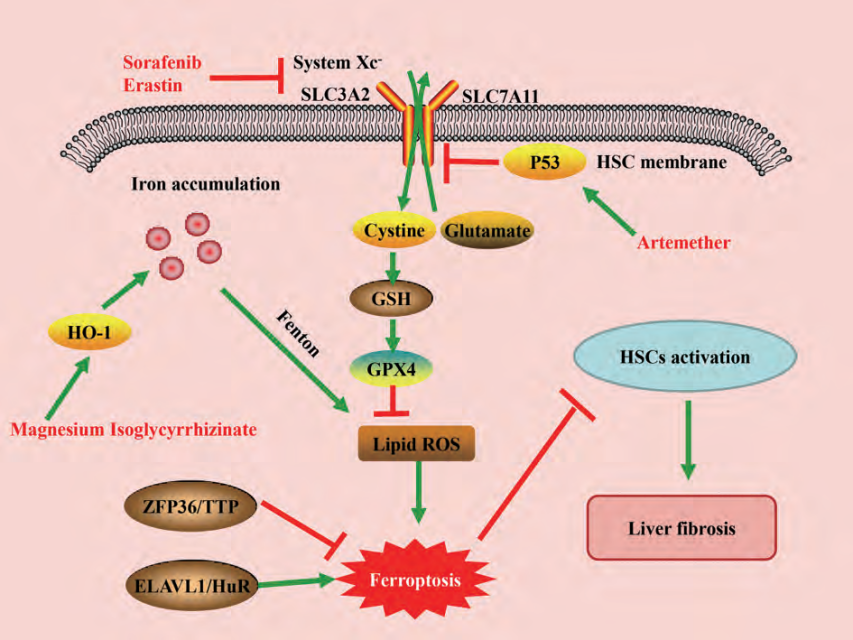
图1:铁死亡在肝纤维化中的相关调控途径

01 RNA结合蛋白ZFP36/TTP和ELAVL1/HuR调控铁死亡
Sui等[2]研究发现在大鼠肝纤维化模型中,异甘草酸镁可诱导 HO-1上调,促进铁和脂质过氧化物的积累,从而促进HSC铁死亡的发生;而通过铁死亡抑制剂ferrostatin-1或沉默HO-1则消除了异甘草酸镁的抗纤维化作用。锌指蛋白36(ZFP36 ring finger protein 36,ZFP36/TTP)和胚胎致死性异常视觉样蛋白1(ELAV like RNA binding protein 1,ELAVL1/HuR) 在调控HSC铁死亡中发挥重要作用,下调 ZFP36和上调ELAVL1可以促进索拉非尼(sorafenib)/erastin介导的HSC铁死亡,减轻小鼠肝纤维化,进一步机制研究发现ZFP36/ELAVL1可能与下游靶基因结合,影响其mRNA稳定性,从而调控HSC中储铁蛋白自噬,释放出铁离子,继而通过芬顿反应产生大量ROS,促进HSC铁死亡[3,4] 。
02 BRD7-P53-SLC25A28轴和Trf调控铁死亡
Zhang等[5]研究发现采用CRISPR/cas9介导的BRD7敲除可减少HSC铁死亡,而特异性BRD7质粒介导的BRD7过表达可促进HSC铁死亡,进一步研究发现BRD7表达升高可通过直接与P53 N-末端转激活域结合促进P53线粒体转位,从而与下游SLC25A28相互作用形成复合物来介导铁死亡的发生。研究者发现小鼠肝细胞特异性敲除Trf表现为肝脏非转铁蛋白结合铁蓄积,加重高铁饮食介导的肝纤维化,而同时特异性敲除小鼠肝细胞Trf和溶质载体家族39成员14(solute carrier family 39 member 14,SLC39A14) 可显著减少肝脏铁的积聚,改善了高铁膳食或四氯化碳注射介导的肝纤维化,这些数据表明肝脏转铁蛋白在维持肝功能方面发挥保护作用,为预防铁过载诱导的肝纤维化提供了一个潜在治疗靶点[6]。
03 P62-Keap1-Nrf2信号通路调控铁死亡
目前研究认为,铁死亡的最终执行机制是由于过量的脂质过氧化物累积引起质膜损伤,造成细胞铁死亡的发生。Sun等[7]研究报道,沉默P62表达会增加erastin/sorafenib诱导的肝细胞癌(hepatocellular carcinoma,HCC) 细胞铁死亡。此外,在HCC细胞移植瘤小鼠模型以及细胞实验中发现,核因子E2-相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2) 敲低也表现出增强erastin/sorafenib抗HCC的作用。这些结果表明,P62-Kelch样ECH关联蛋白1(Kelch-like ECH-associating protein 1,Keap1)-Nrf2信号通路可能在铁死亡中发挥重要作用。因此,Nrf2可能是参与铁死亡及未来治疗多种肝病的重要靶点。

01 靶向system Xc-诱导铁死亡
目前研发发现铁死亡诱导剂主要是通过靶向system Xc-、GSH、GPX4 以及铁离子和ROS实现诱导铁死亡,其中erastin是最早确定的一种特异性铁死亡诱导剂,可靶向抑制system Xc-的活性,影响GSH的合成,促进多种细胞发生铁死亡[8]。
02 靶向铁离子和 ROS诱导铁死亡
研究显示,青蒿素和青蒿荜茇酰胺等多种中药可以通过提高ROS含量,从而影响铁代谢来诱导铁死亡,发挥抗肝癌的作用且毒性较低,是非常有前景的药物[9]。FINO2 是一类具有1,2-二氧戊烷结构的plakinic酸D衍生物,可通过发生类芬顿反应,间接失活GPX4以及直接氧化PUFA的作用诱导细胞铁死亡,且其在铁水平高的肿瘤细胞中作用更强[10]。
03 靶向GSH诱导铁死亡
丁胱亚磺酰亚胺通过抑制GSH合成限速酶-谷氨酰半胱氨酸连接酶(gluta‐mate-cysteine ligase, GCL),降低GSH水平和GPX4活性来促进脂质过氧化,进而诱导多种癌细胞发生铁死亡。顺铂可与GSH直接结合形成Pt(铂)-GSH复合物,导致GSH和GXP4失活,从而促进铁死亡。研究者进一步使用顺铂与erastin联合作用于人肺癌细胞和人结肠癌细胞后发现,联合用药呈现出显著的协同抗肿瘤效应[11]。
04 靶向脂质过氧化抑制铁死亡
糙米提取物可以通过抑制铁死亡来改善GPX4失活导致的脂质过氧化和细胞毒性[12];黄芩苷也可以通过抑制脂质过氧化,减少游离铁蓄积而抑制铁死亡,且其抑制作用明显优于一些典型的铁死亡抑制剂[13]。
05 靶向 ACSL4抑制铁死亡
噻唑烷二酮类药物罗格列酮、吡格列酮和曲格列酮等可特异性抑制ACSL4表达,从而保护细胞免受 RSL3诱导的铁死亡和脂质过氧化。其中,曲格列酮虽抑制ACSL4的效应较低,但可能由于其6-色原烷醇结构而具有固有的抗氧化活性,是噻唑烷二酮类药物中抑制铁死亡作用最强的[14]。一些研究者还将纳米技术与铁死亡研究相结合,利用纳米材料抑制或诱发铁死亡。因此,探索铁死亡诱导剂和抑制剂的作用机制及开发新的靶向铁死亡药物对于治疗肝纤维化具有重要意义。

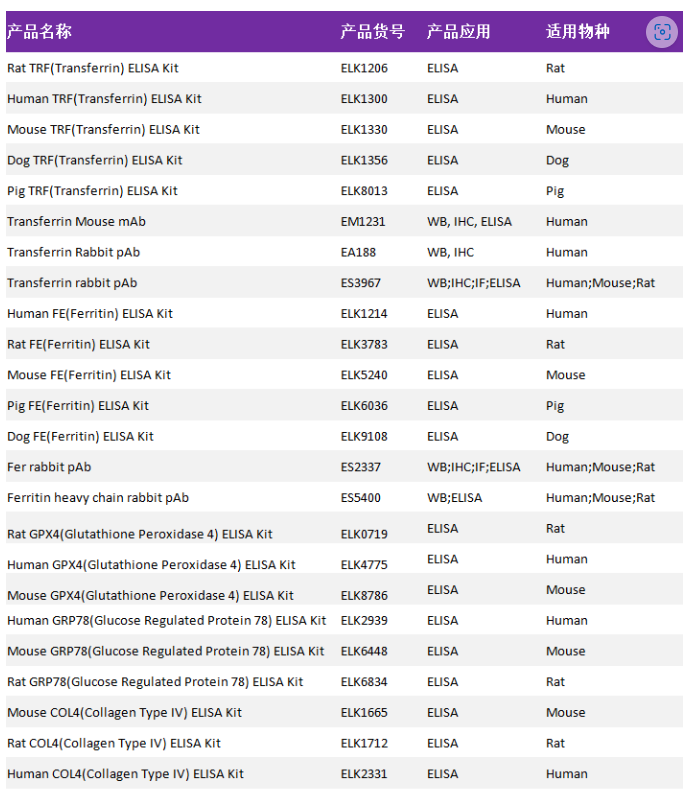
作为生命科学及医学领域的蛋白抗体供应商,ELK biotechnology可为铁死亡相关研究提供高品质的试剂,这里将铁死亡部分产品列出来以便大家参考,详情见下表:
【参考文献】
[1] Anderson ER, Shah YM. Iron homeostasis in the liver [J]. Compr Physiol, 2013, 3: 315-330.
[2] Sui M, Jiang X, Chen J, et al. Magnesium isoglycyrrhizinate ameliorates liver fibrosis and hepatic stellate cell activation by regulating ferroptosis signaling pathway [J]. Biomed Pharmaco‐ ther, 2018, 106: 125-133.
[3] Zhang Z, Yao Z, Wang L, et al. Activation of ferritinophagy is required for the
RNA-binding protein ELAVL1/HuR to regulate ferroptosis in hepatic stellate cells [J]. Autophagy, 2018, 14: 2083-2103.
[4] Zhang Z, Guo M, Li Y, et al. RNA-binding protein ZFP36/TTP protects against ferroptosis by regulating autophagy signaling pathway in hepatic stellate cells [J]. Autophagy, 2020, 16: 1482- 1505.
[5] Zhang Z, Guo M, Shen M, et al. The BRD7-P53-SLC25A28 axis regulates ferroptosis in hepatic stellate cells [J]. Redox Biol, 2020, 36: 101619.
[6] Yu Y, Jiang L, Wang H, et al. Hepatic transferrin plays a role in systemic iron homeostasis and liver ferroptosis [J]. Blood, 2020, 136: 726-739.
[7] Sun X, Ou Z, Chen R, et al. Activation of the p62-Keap1-NRF2 pathway protects against ferroptosis in hepatocellular carcinoma cells [J]. Hepatology, 2016, 63: 173-184.
[8] Dixon SJ, Lemberg KM, Lamprecht MR, et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death [J]. Cell, 2012, 149: 1060-1072.
[9] Ooko E, Saeed ME, Kadioglu O, et al. Artemisinin derivatives induce iron-dependent cell death (ferroptosis) in tumor cells [J]. Phytomedicine, 2015, 22: 1045-1054.
[10] Abrams RP, Carroll WL, Woerpel KA. Five-membered ring peroxide selectively initiatesferroptosis in cancer cells [J]. ACS Chem Biol, 2016, 11: 1305-1312.
[11] Guo J, Xu B, Han Q, et al. Ferroptosis: a novel anti tumor action for cisplatin [J]. Cancer Res Treat, 2018, 50: 445-460.
[12] Xu WH, Li CH, Jiang TL. Ferroptosis pathway andits interven‐ tion regulated by Chinese materia medica [J]. China J Chin Mater Med (中国中药杂志), 2018, 43: 4019-4026.
[13] Xie Y, Song X, Sun X, et al. Identification of baicalein as a ferroptosis inhibitor by natural product library screening [J]. Biochen Biophys Res Commun, 2016, 473: 775-780.
[14] Doll S, Proneth B, Tyurina YY, et al. ACSL4 dictates ferroptosis sensitivity by shaping cellular lipid composition [J]. Nat Chem Biol, 2017, 13: 91-98.
[15] Chen Hao, Li Xiaofeng, Wang Hua. Research progress on the mechanism of iron death in regulating liver fibrosis [J]. Acta Pharmacologica Sinica, 2019,56(11):2916-2922.DOI:10.16438/J.0513-4870.2021-0959.
在线咨询
Online consultation
-
在线咨询
-
技术支持

关注微信公众号




