

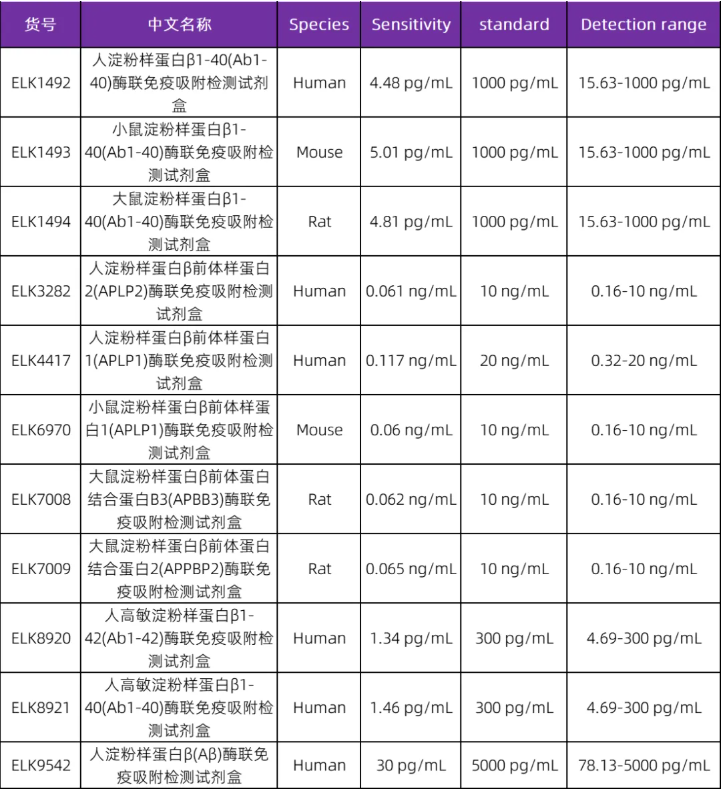
阿尔茨海默症(AD)相关指标--Aβ

背景介绍
淀粉样肽β(Amyloid β,Aβ)是淀粉样前体蛋白(APP)经β-和γ-分泌酶水解后产生的一种含有39-43个氨基酸的多肽。可由多种细胞产生,在血液、脑脊液和间质液中循环。大脑中出现β-淀粉样蛋白斑块,即细胞外的蛋白质沉积物,是阿尔茨海默症的一项主要标志。这些斑块是由单体 Aβ 自发聚集成可溶性 Aβ 低聚物形成的,后者聚集在一起会形成不溶性原纤维。它大部分与蛋白质分子结合,少数以游离状态存在。
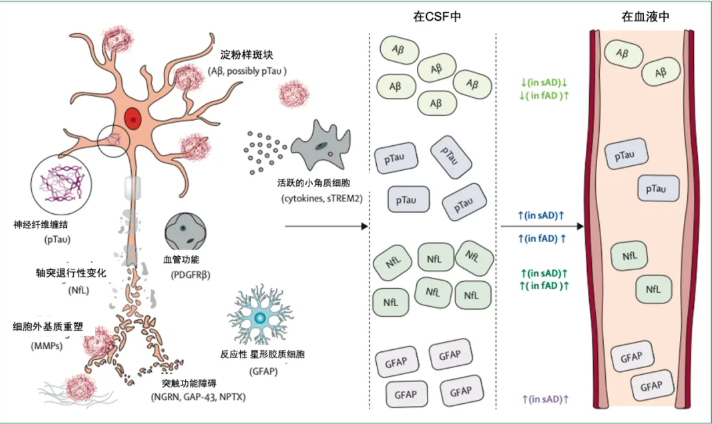
图片来源于 杂志期刊【柳叶刀/神经】,仅供参考
Aβ 的肽链由约 40~43 个氨基酸组成。在 N 末端和 C 末端分别发生几种变异,老人斑积累的代表性物质 Aβ 包括由 40 个氨基酸组成且以 40 号 Val 残基结束的 Aβ40 和由 42 个氨基酸组成以 42 号 Ala 残基结束的 Aβ。由于 Aβ 1-42 多出的两个氨基酸导致错误折叠并聚集的可能性更大,所以一般认为 Aβ 1-42 的有更强的神经毒性。在人脑脊液中,Aβ1-40的含量是Aβ1-42的10倍。且在老人斑形成早期就已经积累起来了。Aβ1-42毒性更强,更易聚集,形成Aβ沉淀的核心,引发神经毒性作用。
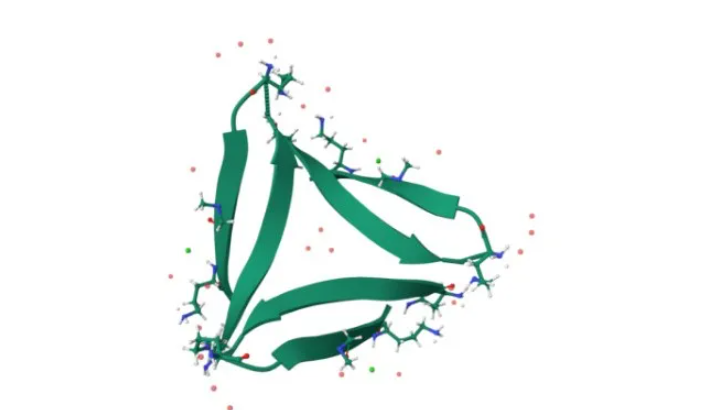
Aβ三聚体x射线晶体结构图(图源:Protein Data Bank)

产生过程
Aβ 是由其前体蛋白 APP 切断出来的肽链片段。APP 是 I 型单向膜贯通性蛋白质,普遍存在于各个组织中。根据氨基酸剪接不同主要分为 695/751/770 三种氨基酸类型,但在大脑中发现较多的是 695 氨基酸的 APP695。在健康的人脑脊髓液中也可检测出 Aβ,它并不是 AD 病患者脑中病变产生的产物,而是 APP 正常代谢过程中产生、分泌的分子。Aβ 是通过对 APP2 阶段的剪切后产生的。首先,APP 的细胞外域被β-secretase切断,细胞外域片段(sAPPβ)被分泌出来。然后γ-secretase切断残留在细胞膜的 APP 的 C 末端断片(C99),并产生 Aβ 和 AICD。Aβ 的 C 末端变异是 γ-secretase 切断时引起的,氨基酸切断的部位不同,可以产生 Aβ37 到 Aβ49 等多种 Aβ。以前人们瞩目于高产生量的 Aβ40,或聚集性毒性高的 Aβ42,APP 代谢过程中,除 Aβ 产生途径外,还存在非 Aβ 产生途径。非 Aβ 产生途径也分为 2 个阶段的剪切,第 2 阶段的剪切酶同样是 γ-secretase,但第 1 阶段的剪切酶为α-secretase。α-secretase 是在 APP 上的 Aβ 内域 16 号 Lys 残基和 17 号 Leu 残基间切断的,产生的约 3kDa 的片段(p3)是缺失 Aβ N 末端域 16 氨基酸的多肽片段。神经细胞中的ADAM10就是主要的 α-secretase。

Aβ在阿尔茨海默病中的具体作用机制
Aβ的异常聚集:在正常生理情况下,Aβ的产生和清除处于平衡状态。然而,在AD患者中,这种平衡被打破,Aβ异常聚集形成淀粉样斑块,对神经元产生毒性作用。
神经元损伤:Aβ斑块的形成会导致神经元死亡和神经退行性病变,进一步影响记忆和认知功能。
炎症反应:Aβ斑块的降解过程中会产生过氧化氢等毒性副产物,加剧神经元死亡和神经退行性病变。
Aβ检测在诊断中的应用
脑脊液检测:通过检测脑脊液中的Aβ1-42、Aβ1-40等指标,可以评估阿尔茨海默症的病理学改变。Aβ1-42水平下降提示可能出现AD病理学改变,需结合临床症状和其他检测结果进行综合判断。
早期检测:Aβ1-42/Aβ1-40比值在诊断前14年即发生变化,这为早期诊断提供了重要依据。

在线咨询
Online consultation
-
在线咨询
-
技术支持

关注微信公众号




