

Western Blot完全指南:手把手教你避开科研深坑!
【重磅干货】
Western Blot完全指南:手把手教你避开科研深坑!
查看详情↓↓↓❤️❤️❤️
01.Western blot 的起源
1975年,Edwin Southern发明了DNA杂交检测技术,命名为Southern blot。
1977年,James Alwine、David Kemp和George Stark发明了RNA杂交检测技术,命名为Northern blot。
1979年,位于美国斯坦福大学的George Stark发明了将蛋白从电泳凝胶上转移到活化纤维素上的技术,随后Harry ToWestern blotin发展出更快速、简单的“三明治”结构电转技术。
1981年Neal Burnette为了方便推广这一技术正式将这一技术命名为“Western blot”
02.Western blot 的用途
①确定目的蛋白的表达情况
这是Western blot最常规的应用,如检测患者的标本与正常人的标本、实验条件处理后细胞与未处理的对照细胞之间目的蛋白的表达变化情况,通过灰度分析可以确定目的蛋白表达水平是升高还是降低。
②研究蛋白间的相互作用
这是与免疫共沉淀(Co-immunoprecipitation,Co-IP)技术相结合的一种检测蛋白质之间相互作用的常用方法。通过CO-IP技术将相互作用的蛋白质复合体分离出来后进行凝胶电泳,然后利用相互作用的蛋白质的特异性抗体进行检测。适用于对已知的蛋白质的相互作用进行检测,不适用于检测一个蛋白质未知的相互作用蛋白;也可以用于蛋白质-DNA、蛋白质-RNA相互作用的后续分析。
③确定目的蛋白的细胞定位
通过分别提取细胞不同部位的蛋白质,如膜蛋白、胞浆蛋白核蛋白或线粒体蛋白等,将分离出来的不同部位的蛋白质进行Western blot检测可以分别检测目的蛋白在不同部位的表达情况。
03.Western blot 的原理
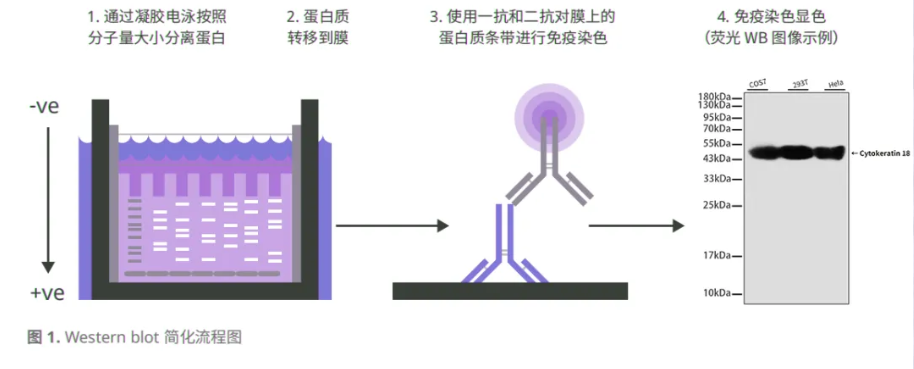
01.通过凝胶电泳按照分子量大小分离蛋白。
02.将凝胶紧贴膜放置,同时施加电流引导蛋白从凝胶迁移到膜上。进行免疫染色时,由于电泳凝胶不利于抗体与其中的蛋白结合,所以需要进行蛋白转膜。
03.过靶向目标蛋白的特异性抗体进一步孵育膜,再通过二抗和检测试剂显示检测信号。
04.Western blot 抗体选择
避坑指南:抗体选择的黄金法则
Western blot 的灵敏度和特异性取决于抗体的质量和使用抗体的实验条件。在使用含有血清和内源性免疫球蛋白的组织裂解液或组织培养上清液时,所选一抗的种属应有别于样本种属。例如,如果您研究的是小鼠蛋白,应选择在非小鼠的种属中培养的一抗(例如在兔中培养的一抗)。这是为了避免免疫球蛋白二抗与样本中的内源性免疫球蛋白发生交叉反应。使用不含内源性免疫球蛋白的样本时,一抗宿主种属的选择相对没那么严格。
为了使蛋白显色,需要选择一种可与一抗结合的(不同于一抗宿主种属的)二抗。使用酶联二抗,例如辣根过氧化物酶 (HRP) 偶联抗体或碱性磷酸酶 (AP) 偶联抗体,或者经Western blot 优化的荧光偶联抗体,可以提高灵敏度。记得确认偶联抗体的光发射波长是否与您的读数装置/扫描仪兼容。
与单独的一抗相比,偶联二抗的灵敏度更高,因为二抗可以在多个位点与一抗结合,从而增强信号。信号增强有利于检测复杂蛋白混合物中的目标蛋白,所以二抗非常适合用于 Western blot。

在线咨询
Online consultation
-
在线咨询
-
技术支持

关注微信公众号




